今回は、化学物質(分子)の集合体としてのふるまいについて話をします。
今まで、化学者は、「化学物質の構造を、電子の雲として考えて、電子を授受しやすいか、どの部分がどういう反応をするか、どんな色を持つかなど、化学構造を見るだけである程度分かる」という話をしてきました。(「化学物質の毒性の予測」「ナノマテリアル」参照)
しかし、化学物質は、その分子としてのふるまいのほかに、多くの分子が集まって特徴的な性質を示します。では、化学者は、頭の中だけで、これら分子の集合体としての予測を、どの程度できるでしょうか? これらについても、分子間に働く力を考えて、ある程度予測することができますが、残念ながら、分子のふるまいに比べて予測は難しいと言わざるをえません。理由は、多くの分子の間にはさまざまな力が働き、また、周りの溶媒などの効果も考えないといけないので複雑になるからです。
これは、コンピュータを用いて予測しても同様です。分子のふるまいの予測には分子軌道計算や分子力場計算などを用いますが、分子集合体としてのふるまいの予測には、分子動力学法(モレキュラーダイナミクス)などが用いられ、より多くのコンピュータのマシンパワーを要します。
分子の集合体において、それぞれの分子の間には、さまざまな力が働きます。
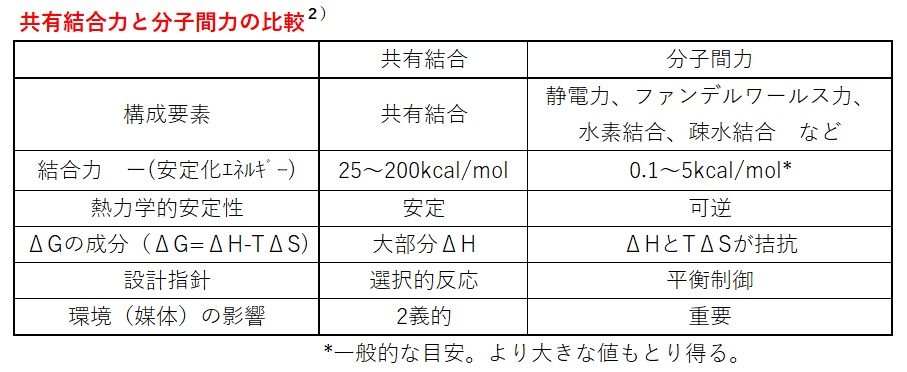
以下に、共有結合力と分子間力を示しました。当然ですが、共有結合力は、分子間力に比べて、とても大きいことが分かります。静電力はイオン結晶中では大きな力を持ちますが、誘電率の高い媒体の中では弱くなります。例えば、NaCl結晶の結合力は120kcal/mol程度ですが、水の中で誘電率が78.5になると、結合力は1〜2kcal/mol程度とかなり小さくなります。
基本的に、分子間力は室温(25℃)での熱エネルギー(0.59kcak/mol)と同等の弱い相互作用と言えます。
なお、特殊な相互作用として重要な水素結合は、本質的にはCT相互作用であり、その結合力は2〜10kcal/mol程度です。また、疎水相互作用は、本質的には溶媒和型相互作用でありエントロピー項の寄与が大きくなっています。例えば、シクロヘキサン間の疎水結合力は3kcal/mol程度です。

1) 米沢貞次郎、永田親義、加藤博史、今村詮、諸熊けい治、「三訂量子化学入門」、化学同人(1983年刊)
共有結合と分子間力の比較を以下にまとめました。分子間力を利用する場合、熱力学的に平衡状態にあることを前提にする必要があります。また、平衡の安定性については、エンタルピーだけでなくエントロピーも考慮する必要があります。つまり、分子間力を利用した集合体形成の際、エンタルピー的には安定化しますが、エントロピーは減少するので常に不安定化の方向に寄与します。さらには、媒体の誘電率などの環境要因で、分子間力は変化することを考えなければなりません。
 2)G.M.Whitesides,E.E.Simanek,J.P.Mathias,C.T.Seto,D.N.Chin,M.Mammen,D.M.Gordon,Acc.Chem.Res.,28,37(1995)
2)G.M.Whitesides,E.E.Simanek,J.P.Mathias,C.T.Seto,D.N.Chin,M.Mammen,D.M.Gordon,Acc.Chem.Res.,28,37(1995)
安定化エネルギー(ΔG)と平衡定数(K)の関係は、以下の式(1)で表されます。 ΔG=-10kcal/molであれば、25℃で、K=2.27*107 になるので、最低限必要な分子間力として10kcal/molを想定すればよいと思われます。
K=exp-ΔG/RT (logK=-0.434ΔG/RT) (1)
さて、分子集合体としてのふるまいを制御するための、さまざまな方法が知られています。例えば、液晶、ミセル、2分子膜、ホストーゲスト相互作用などが挙げられます。これらについては、別の機会に紹介したいと考えています。
なお、さらに複雑なのが生物であり、生物のふるまいの予測が難しいのは仕方のないところです。
ランキングに参加中。クリックして応援お願いします!
![]()
にほんブログ村

動物・生物ランキング